L’Agence Nationale de Sécurité du Médicament et des Produits de Santé (ANSM) a été informée par la société Philips de sa volonté de retirer mondialement certains appareils de ventilation mécanique, suite à l’identification d’un possible problème de conception de la mousse insonorisante présente dans ses dispositifs médicaux.
La société Philips, qui se spécialise désormais dans les équipements médicaux et les produits de santé, rappelle ses appareils destinés aux patients souffrant d’apnée du sommeil ou nécessitant une assistance respiratoire., utilisés principalement à domicile Selon les premières analyses, l’exposition à cette mousse pourrait provoquer dans certains cas des effets immédiats : irritation (peau, yeux et voies respiratoires), réaction inflammatoire, céphalées, asthme. D’après le fabricant, une exposition à long terme serait susceptible d’entraîner des effets indésirables sur d’autres organes et un risque cancérigène.
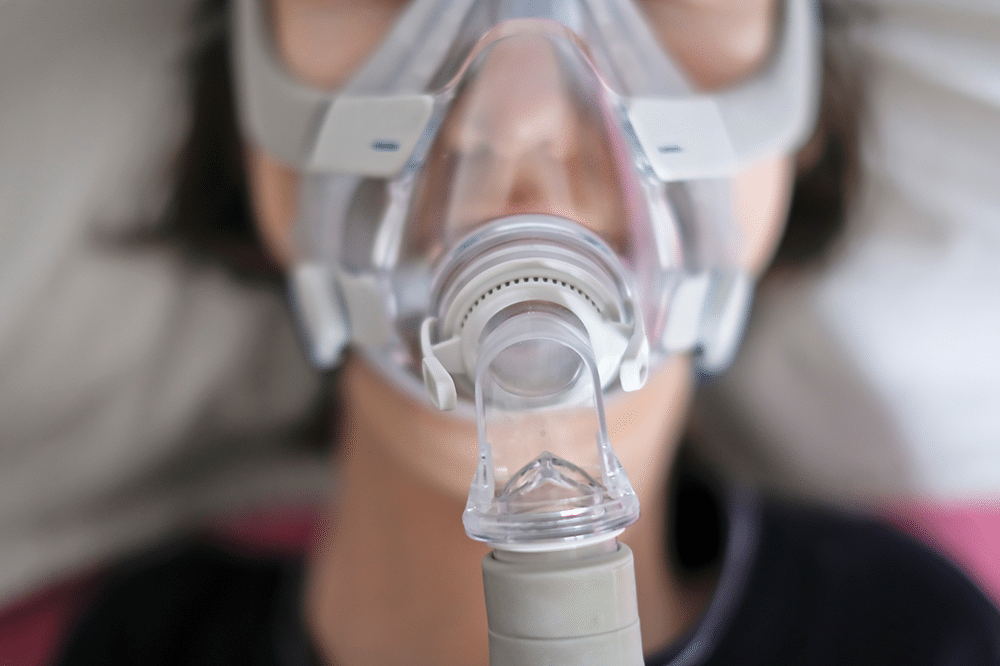
Les dispositifs concernés sont des ventilateurs utilisés à domicile, à l’hôpital, et dans les établissements sanitaires pour les patients ventilo-dépendants, à savoir :
- Des ventilateurs avec support de vie (Trilogy100, Trilogy200) utilisés à domicile, à l’hôpital, et dans les établissements sanitaires pour les patients ventilo-dépendant;
- Des ventilateurs sans support de vie (auto, autoSV, S/T et AVAPS, Omnilab Advanced +, REMstar Pro, Auto, Expert et Dreamstation Go) utilisés à domicile pour les patients atteints, notamment de BPCO, de syndrome d’obésité, de cyphoscoliose et de pathologie neuromusculaire ;
- Des appareils de pression positive continue (PPC) utilisés à domicile principalement pour traiter le syndrome d’apnée du sommeil.
L’ensemble des appareils précités fabriqués avant avril 2021 sont concernés, soit entre trois et quatre millions d’appareils dans le monde, sachant qu’une pénurie pourrait intervenir suite à ce rappel puisque Philips ne sera pas en mesure de servir de nouveaux clients.
Conduite à tenir pour les patients (mis à jour le 08/07/2021)
L’ANSM recommande, en concertation avec les professionnels de santé, de ne pas arrêter votre traitement, quel que soit le type d’appareil utilisé.
Votre pneumologue ou prestataire de soins à domicile vous contactera afin d’organiser la réparation ou le remplacement de vos équipements, selon la disponibilité du matériel.
En cas de céphalées, d’irritation (peau, yeux, voies respiratoires), de réactions inflammatoires, de toux, de pression thoracique, d’asthme et d’infection des sinus, et autres symptômes pouvant être liés à l’utilisation du dispositif, contactez votre médecin.
Nous vous invitons également à faire une déclaration sur le portail des signalements (votre médecin peut vous aider à faire cette déclaration).
De la nécessité de soumettre les dispositifs médicaux à une autorisation de mise sur le marché
Dans ce contexte, France Assos Santé regrette que la première communication de Philips, en date du 14 juin, se soit contentée de viser principalement à rassurer ses investisseurs. Elle dénonce par ailleurs le fait que Philips ait enfreint son obligation de consulter préalablement l’ANSM, notamment concernant la définition de la conduite à tenir à destination des personnes malades.
Plus largement, France Assos Santé déplore que, contrairement aux médicaments, les dispositifs médicaux – y compris les plus à risque – ne fassent toujours pas l’objet d’une obligation d’autorisation de mise sur le marché (AMM). La certification CE actuellement en cours est régulièrement remise en cause pour ne pas apporter de gages suffisants de sécurité. Il est primordial que la France porte au niveau européen la mise en place d’une véritable AMM pour les dispositifs médicaux les plus à risques. Le règlement européen qui entre actuellement en vigueur n’apporte pas cette garantie malgré les dernières alertes, notamment suite aux « implant files ».
D’autre part, France Assos Santé continue de regretter que la France ne possède toujours pas de dispositif centralisé pour informer rapidement et directement l’ensemble des personnes concernées par une alerte sanitaire.
En savoir plus :
Sur le même sujet
Aucun article en relation avec ce sujet pour le moment.


Bonjour,
Suite à votre article, j’aimerais savoir si je suis concerné car j’utilise une respironics avec un humidificateur que j’utilise exceptionnellement.
je n’ai pas d’effet secondaire à son utilisation.
Cordialement.
PS: Mon fournisseur est ISIS médical.
Bonjour, et merci pour votre commentaire.
Afin d’être certain que vous n’êtes pas concerné, nous vous recommandons de contacter votre pneumologue ou votre fournisseur. En attendant, nous vous rappelons le lien vers le point de situation de l’ANSM, qui résume les recommandations pour les patients.
https://ansm.sante.fr/actualites/point-de-situation-sur-les-dispositifs-de-ventilation-et-ppc-de-la-societe-philips
Bonne journée,
L’équipe France Assos Santé
Je viens de recevoir ce message et vous en remercie. Heureusement que je suis RU et tenu au courant par des articles de france Assos. Les autres font comment ,
J’ai donc appelé mon fournisseur d’appareil, qui est au courant mais Philips ne lui a pas encore fais savoir si cela concernait ses appareils. Donc ils sont en attente.
Mon médecin neurologue ne peut plus être joins avant lundi et la clinique du sommeil demande que je les rappele lundi.
Donc le flou total.
cordialement Raymond
Bonjour,
Cela fait 3 ans que j’utilise une machine PPC pour mon apnée du sommeil. Depuis 3 ans, mon état respiratoire s’est nettement dégradé, au point que j’entre en centre de réhabilitation respiratoire. Mon prestataire vient me changer la machine demain, j’ai rdv avec mon pneumologue pour traiter mon asthme qui est extrêmement difficile à soigner !!!! J’ai également les sinus bouchés, les céphalées font parties de mon quotidien et ma dyspnée est côté à III…
Quotidien difficile, mais je ne laisserai pas toutes ces souffrances sans réponses…
Bonjour, je viens de recevoir un courrier de mon prestataire LVL Médical et de prendre connaissance du problème.
Quel manque de réactivité ! Et on nous demande de continuer le traitement jusqu’au remplacement qui peut prendre 9 mois ! appareillée depuis 4 ans et demi ,ça fait 2 ans que j interpelle le technicien car je me réveille épuisée , avec migraine et nausée ; j’ai maintenant une inflammation chronique des sinus et de l’arrière gorge pour laquelle l’ORL m’a dit que c’était courant , donc normal chez les utilisateurs de PPC ; et une névralgie du trijumeau gauche sans explication pour le neurologue…et je lis maintenant qu’il n’y a pas d’ AMM pour ces dispositifs médicaux !
Traité depuis de décennies pour apnée, j’ai récemment trouvé de la suie sur mes filtres qui étaient bouchés. J’ai mis cela sur le compte d’une pollution extérieure, avant de tomber par hasard sur cette info de rappel. Vérification faite, mon appareil est bien concerné d’aprés son n°. Mon prestataire à qui je reprochais son silence m’a répondu que c’était les consignes de l’ANSM! Il me demande de continuer le traitement encore 5jours en attendant le technicien et donc de continuer à avaler cette suie noire…
En plus de l’apnée, j’ai des problèmes cardiaques, de l’hypertension et depuis un certain temps de fortes nausées, des yeux irrités, de la toux et des problèmes de sinus. Je viens juste de comprendre l’origine de certains de ces problèmes que mon médecin ne savait pas traiter, et pour cause!
bonjour
Voudrais savoir si mon appareil PPC est concerné par ce problème grave.
Dreams station auto CPAP
AFLEX FR
Ref : FRX 500514
Bonjour, et merci pour votre commentaire.
Pour savoir si vous êtes concerné, nous vous recommandons de contacter votre pneumologue ou votre fournisseur.
Retrouvez également les dernières informations données par l’ANSM.
Bonne journée,
L’équipe France Assos Santé
je pense au n°FRX500S14 et non FRX500514
Bonjour
Suite à appel aupres de la personne qui me suit ,l’appareil philips FRX500S14 de 6/2019, me sera échangé demain par une autre marque
Bonjour, Depuis septembre 2019 j’ai un appareil Philips pour les apnées du sommeil.
Il y a 10 mois environ, j’ai reçu un courrier de la société qui me suit prévenant que mon appareil serait prochainement changé suite à un problème de déterrioration des mousses.
Ne voyant rien venir, j’ai tél et on m’a répondu que je n’étais pas concerné, que seuls les USA seraient remplacés.
Depuis 4 à 5 mois, j’ai des soucis de gorge, sinus etc..
j’ai eu plusieurs traitements dont des antibiotiques, vu 3 fois l’ORL, scanner des sinus, et après demain échographie du cou car j’ai des ganglions, une grosseur et des douleurs.
Vers la mi janvier j’ai téléphoné à la société en expliquant mes soucis de gorge, ils sont venus très vite me le remplacer par l’équivalent en neuf. Le 24 janvier 2022.
Le technicien m’a bien dit que l’appareil n’était pas en cause.
Ce jour, 7 février 2002, je découvre le problème de ces appareils par hasard sur internet.
Bonjour, et merci pour témoignage.
France Assos Santé se mobilise depuis plusieurs mois pour que lumière soit faite sur ce sujet, et nous restons vigilant pour tenir informer les usagers.
Bonne journée,
L’équipe France Assos Santé
Je ne comprends pas pourquoi moi personnellement je n’ai pas été prévenue que l’appareil avait un problème de detoriation de mousse et ce malgré le déplacement du technicien chez moi à maintes reprises pour réglages a aucun moment il m’en a parlé pourtant je ne pouvez pas utiliser mon appareil car j’avais très mal aux sinus je sentais des brûlures aux sinus maux de gorge insupportables et pas un jour il m’a parlé de changement d’appareil pour motif detoriation de mousse c seulement aujourd’hui que j’ai vu ça sur Internet et ce problème est depuis 2021 .je voudrais savoir pourquoi je n’ai pas été avisé du probleme.
Bonjour et merci pour votre témoignage.
France Assos Santé se mobilise depuis plusieurs mois pour que lumière soit faite sur ce sujet, tout en alertant Philips et les autorités compétentes sur la non-communication du fabricant.
L’ANSM a publié en juin une première information que nous avions relayé, mais ce n’est évidemment pas assez communiqué, et nous poussons les autorités sanitaires à mettre en place un système de communication efficace pour contacter directement les utilisateurs des dispositifs médicaux.
Nous vous joignons la note de l’ANSM pour en savoir plus sur l’attitude à adopter en tant qu’utilisateur de cet appareil : https://ansm.sante.fr/dossiers-thematiques/appareils-de-ventilation-philips/les-risques-identifies
Courage à vous, et soyez sûr que nous resterons vigilants et tiendrons informé les usagers de la santé des avancées que nous pourrons obtenir sur le sujet.
Bonne journée,
L’équipe France Assos Santé
Bonjour,
J’ai appris ces jours ci les problèmes liés au respirateur Philips avec lequel je suis appareille pour apnées du sommeil depuis 9 ans et demi, j’ai aussi des particules noires dans le boîtier et malgré les avis qui se veulent rassurants de mon médecin et du technicien je suis très inquiète et angoissée.
Bonjour et merci pour votre témoignage.
France Assos Santé se mobilise depuis plusieurs mois pour que lumière soit faite sur ce sujet, tout en alertant Philips et les autorités compétentes sur la non-communication du fabricant.
L’ANSM a publié en juin une première information que nous avions relayé, mais ce n’est évidemment pas assez communiqué, et nous poussons les autorités sanitaires à mettre en place un système de communication efficace pour contacter directement les utilisateurs des dispositifs médicaux.
Nous vous joignons la note de l’ANSM pour en savoir plus sur l’attitude à adopter en tant qu’utilisateur de cet appareil : https://ansm.sante.fr/dossiers-thematiques/appareils-de-ventilation-philips/les-risques-identifies
Courage à vous, et soyez sûre que nous resterons vigilants et tiendrons informé les usagers de la santé des avancées que nous pourrons obtenir sur le sujet.
Bonne journée,
L’équipe France Assos Santé
Bonjour,
J’ai pris connaissance du problème grâce à l’information donnée il y a 2 jours par RMC. Du coup après recherche, je suis tombée sur votre site et votre article. J’utilise un des appareils concernés. Je confirme n’avoir reçu aucune information à ce sujet. J’ai demandé au prestataire qui me met à disposition l’appareil s’il était concerné. Il m’a répondu en pas être en mesure de me le confirmer car Philips ne donne aucun élément d’information. Il m’a toutefois proposé de me le remplacer rapidement. Apparemment la presse nationale a repris l’information d’RMC. j’espère que cela va faire bouger les choses. Cordialement. Nancy Lopez
Bonjour et merci pour votre témoignage.
France Assos Santé se mobilise depuis plusieurs mois pour que lumière soit faite sur ce sujet, tout en alertant Philips et les autorités compétentes sur la non-communication du fabricant.
L’ANSM a publié en juin une première information que nous avions relayé, mais ce n’est évidemment pas assez communiqué, et nous poussons les autorités sanitaires à mettre en place un système de communication efficace pour contacter directement les utilisateurs des dispositifs médicaux. Nous espérons également que cette mise en lumière médiatique forcera les acteurs concernés à agir devant l’urgence que représente ce sujet.
Nous vous joignons la note de l’ANSM pour en savoir plus sur l’attitude à adopter en tant qu’utilisateur de cet appareil : https://ansm.sante.fr/dossiers-thematiques/appareils-de-ventilation-philips/les-risques-identifies
Courage à vous, et soyez sûre que nous resterons vigilants et tiendrons informé les usagers de la santé des avancées que nous pourrons obtenir sur le sujet.
Bonne journée,
L’équipe France Assos Santé
j’ai été prevenu par mon prestataire LVL il y a 8 mois qu’il viendrait pour un changement de « mousse » mais qui n’est pas grave. Aujourd’hui, toujours rien. Je suis atteint de BPCO, insuffisant cardiaque et depuis plus de 6 mois, j’ai les sinus bouchés, les yeux et la peau du visage irrités, ainsi que des nausées. Vous pouvez imaginer que les informations qui « tombent » aujourd’hui m’inquiètent au plus haut point. J’ai contacté LVL qui m’a dit d’appeler Philips, lequel m’a renvoyé auprès de LVL ? Que faire ? On se sent démuni et seul.
Bonjour et merci pour votre témoignage.
France Assos Santé se mobilise depuis plusieurs mois pour que lumière soit faite sur ce sujet, tout en alertant Philips et les autorités compétentes sur la non-communication du fabricant.
Nous vous joignons la note de l’ANSM pour en savoir plus sur l’attitude à adopter en tant qu’utilisateur de cet appareil : https://ansm.sante.fr/dossiers-thematiques/appareils-de-ventilation-philips/les-risques-identifies
Courage à vous, et soyez sûr que nous resterons vigilants et tiendrons informé les usagers de la santé des avancées que nous pourrons obtenir sur le sujet.
Bonne journée,
L’équipe France Assos Santé
Merci de votre engagement et des informations claires dans l’etat actuel. Un de mes parents est concerne, la machine etant dans son cas vitale. Il est tres surprenant que le fabricant ne communique pas plus surtout sur des enjeux de sante publique tel que celui-la. Il est surtout triste de voir que certaines geographies sont priorisees par rapport aux autres (USA, Canada ou Australie en autre). L’Europe est bien derriere.
Les pouvoirs publics n’ont ils pas de leviers ?
Faut il passer au journal aux heures de grandes ecoutes.
Ce n’est pas frustrant, c’est irritant.
Un groupe de patients pour échanger : https://www.facebook.com/groups/1512967969087026
j e suis au courant seulement depuis le 16 fevrier depuis nevembre j ai gros vertiges avec chute et petites neauses je vie seule * depuis 2 a3 semaines difficultes a m alimmente perdu 3 kg mon medecin et pas au courant je doit passer un scanner le 9 mars du ventre j ai telephone 2fois reponse du fournisseur voir le medecin qui me donne quelque chose ils on des appareils au compte goutte attendre* avec un medecin qui ne se deplace pas au domicile je vais prepare mon testament****
Bjr, j’ai des problèmes d’apnée du sommeil. Ce tohu- bohu au sujet du materiel de Philipps m’inquiète. Je dispose du materiel RESMED. Ce type de materiel est il concerné par les restrictions de son utilisation. Est il encore recommandé d’utiliser ce materiel? Merci.
Bonjour,
L’Agence de sécurité du médicament (ANSM) a questionné Philipps.
ResMed n’est pas concerné par les problématiques sanitaires.
L’équipe France Assos Santé
Bonjour, je suis appareillée depuis 2011 et on m’a détecté une bronchopathie et emphysème en 2020. Je tousse de plus en plus avec d’autres problèmes, maux de tête, difficultés à respirer, fatigue et difficultés à dormir et prise de poids avec une hyper tension et cholestérol. Je n’ai pas d’allergie. Que puis-je faire ?
Bonjour, et merci pour votre commentaire.
France Assos Santé n’est pas habilité à donner un avis médical sur une situation particulière. C’est pourquoi nous vous invitons à vous rapprocher de votre médecin traitant qui pourra vous conseiller efficacement.
L’équipe de France Assos Santé